寧波正規外泌體提取試劑直銷價
外泌體的提取方法,先用含無外泌體血清的培養基對人脂肪來源間充質干細胞進行饑餓培養,這樣可使干細胞處于正常生長狀態,不會被克制生長增殖,其所分泌的外泌體所包含的有效物質也更貼近其自然狀態下的外泌體,然后將含有外泌體的培養上清液進行低速差速離心(即先一離心處理、再第二離心處理)以去除細胞及其碎片,用100kd超濾管對低速差速離心后的離心液進行超濾濃縮得到外泌體濃度更高的超濾液,將超濾液經過第三離心處理去除雜質后直接用0.22μm過濾器過濾除菌,過濾掉粒徑為220nm以上的物質,進一步得到含顆粒粒徑小于220nm的濃縮液,因超濾濃縮處理和第三離心處理使得液體量濃縮,這樣過濾除菌效率得到較大提高,較后將濃縮液進行超速離心的第四離心處理分離提取到外泌體。外泌體提取:在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層。寧波正規外泌體提取試劑直銷價
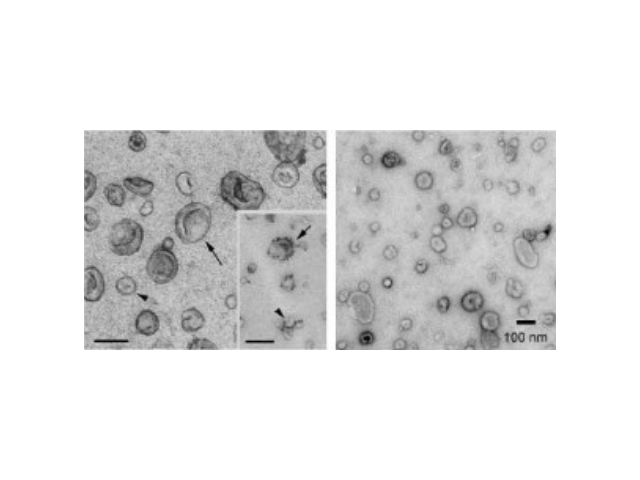
外泌體的提取、分離方法:梯度密度離心法。研究發現,外泌體的密度在1.1~1.19kg·L-1之間,因此,可以采用密度梯度離心法來分離外泌體。該方法是將超速離心結合蔗糖密度梯度或蔗糖墊結合,原理是先除去非囊泡物質,再通過梯度密度濃縮提取外泌體,該方法可以得到相對較為純凈的外泌體。傳統的梯度密度方法通常需要離心16h,但是2012年,研究者[15]使用了62~90h才分離出某些確切囊泡,因此,該方法可能不足以沉淀所有的外泌體。如果離心時間不充足,污染物質可能和外泌體保持在相同的密度層,特別是這個密度范圍又比較寬。杭州正規外泌體提取試劑廠家外泌體檢測作為一種新型的液體活檢熱點技術已被許多臨床科研機構普遍地應用于一些病癥和疾病的無創診斷。
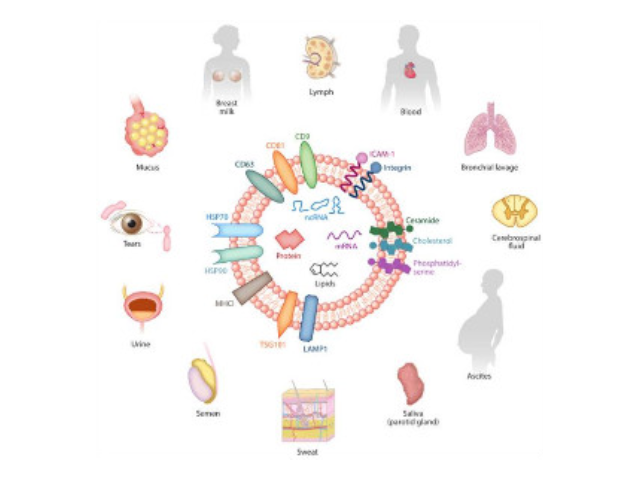
由歐洲多國細胞外囊泡領域的學者發起并成立的國際細胞外囊泡協會(ISEV)于2014年在協會會刊JournalofExtracellularVesicles發表了一個指導性意見,也就是我們常說的MISEV2014。2018版《指導要求》進行了修訂。2018版的《指導要求》首先討論了對這些細胞來源的非細胞具膜結構如何稱呼。學者們普遍認為應當使用細胞外囊泡(extracellularvesicle)來稱呼這些具膜囊泡,當我們使用常規方法分離這些結構時不推薦使用其他的名稱來稱呼它們。
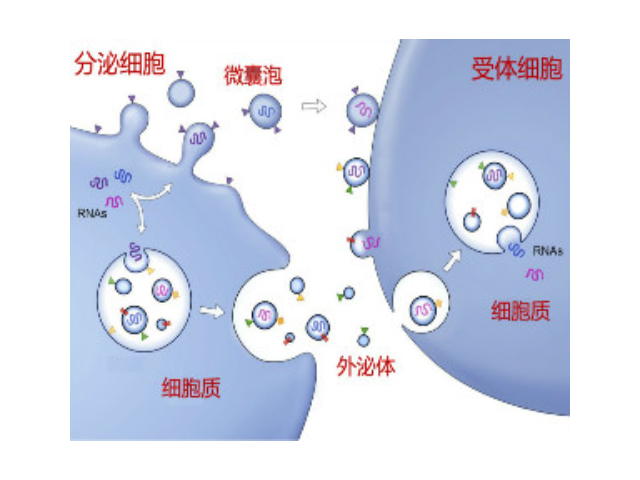
外泌體是細胞間進行物質運輸和信息交流的重要工具,可以通過調節免疫功能促進一些病癥的增殖,血管新生和一些病癥轉移。與細菌傳染,幫助細菌逃避免疫關系很大,并與心血管疾病,老年癡呆等疾病具有密切關系。外泌體可通過流式、WB(檢測指標有CD9,CD63,CD81)、電鏡觀察、NTA粒徑追蹤等手段檢測,普遍應用于藥物載體、疾病診斷marker、精細醫療、一些病癥治病等方面研究。由于外泌體直徑小,樣本含量低,提取十分困難。已有的外泌體分離方式有密度梯度離心、超濾離心法、免疫磁珠抗體捕獲、商用試劑盒等。但到目前為止,仍沒有一種提取方法能同時保證外泌體的含量、純度以及生物活性。外泌體提取:高速離心沉淀外泌體。
外泌體的生物學功能研究中需要分離完整的外泌體顆粒,而傳統超速離心方法步驟繁瑣、硬件要求高、操作難度大。李記生物自主開發的外泌體快速提取試劑盒,組分經過優化處理,適用于細胞培養上清液、血清、血漿、尿液及其他體液(腦脊液、腹水、羊水、乳汁以及唾液等)中的外泌體提取,并搭配純化過濾裝置,可快速高效地獲得高純度外泌體顆粒。注意事項:1.對于待測樣品粘度過大時,可將樣本用4℃預冷的1×PBS緩沖液進行等體積稀釋處理。2.當血清、血漿、唾液等樣品收獲的外泌體濃度較高,收獲的外泌體顆粒無法通過EPF柱純化時,可用4℃預冷的1×PBS進行稀釋后再通過EPF柱離心。3.針對外泌體標志蛋白(CD63,CD9,CD81等)進行Westernblot檢測,可以鑒定所提的外泌體。通過超速離心(120000g/分鐘)20小時以上才能獲得足夠的外泌體量外泌體提取:根據外泌體的大小,從蛋白質和其他大分子中分離外泌體。無錫外泌體提取試劑廠家供應
由于外泌體的特殊結構和功能,使得它具有潛在的應用價值。寧波正規外泌體提取試劑直銷價
外泌體的提取、分離方法:微流控技術。微流控是利用微納米級尺寸的管道來處理和操控流體所涉及的一門技術,其在外泌體分離方面的應用受到越來越多學者的關注。Jie等[16]課題組開發了一種三維納米結構微流控芯片,微柱陣列通過化學沉積將交叉多壁碳納米管功能化,然后其就可以識別特定的分子(CD63)并利用獨特拓撲納米材料高效的捕獲外泌體。Wunsch等[17]利用硅工藝生產納米級確定性側向位移(Nano-DLD)芯片,得到了均勻的間隙尺寸,該芯片可以靈敏地將20~110nm的顆粒分離。該研究證明了外泌體基于大小的位移,從而揭示了利用芯片分選和量化納米級生物膠體的潛力。寧波正規外泌體提取試劑直銷價
- 金華正規無血清細胞凍存液供應商 2025-05-01
- 杭州深圳RNA提取試劑 2025-05-01
- 溫州正規RNA提取試劑服務電話 2025-05-01
- 徐州正規外泌體提取試劑廠家推薦 2025-05-01
- 重慶外泌體提取試劑銷售廠家 2025-05-01
- 南京無血清細胞凍存液直銷價 2025-05-01
- 天津正規RNA提取試劑進貨價 2025-05-01
- 金華開封RNA提取試劑 2025-05-01
- 蕪湖外泌體提取試劑產品介紹 2025-04-30
- 石家莊正規鼠尾膠原單價 2025-04-30
- 南通復配營養預混料規格 2025-05-01
- 南通復配營養預混料乳飲料售價 2025-05-01
- 上海維生素k2原料供貨商 2025-05-01
- 杭州結構膠中空膠有哪些 2025-05-01
- 蘇州環保軋制液品牌 2025-05-01
- 上海有機硅密封膠售價 2025-05-01
- 中國臺灣減排水處理設備價格表 2025-05-01
- 杭州深圳RNA提取試劑 2025-05-01
- Jama全合成柴機油加美潤滑油好不好 2025-05-01
- 南通汽車密封膠大概價格多少 2025-05-01