寧波中國eCTD服務放心可靠
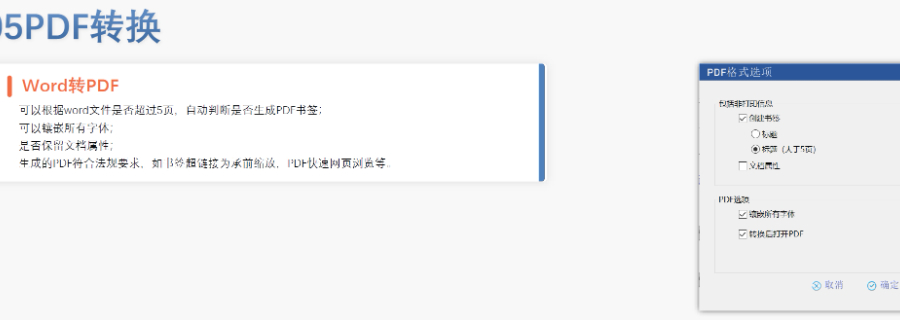
eCTD文件制作需遵循嚴格的法規要求和標準化流程,以下是關鍵要點整理:eCTD采用模塊化結構,包含模塊1(行政信息)至模塊5(臨床報告),需按ICH和監機構要求構建目錄樹。顆粒度選擇:文件提交層級需在***申報時確定并沿用,例如原料和制劑的章節(如、)需按比較低顆粒度拆分,輔料單獨成章。PDF需添加書簽(導航目錄)和超鏈接(跨網頁跳轉),超過5頁的文件必須包含目錄(TOC/LOT/LOF)。技術參數:初始視圖需設置默認縮放級別和頁面布局,書簽展開層級不超過三級,單文件大小需符合申報系統限制。驗證工具:使用軟件(如BXeCTD)自動生成書簽和超鏈接,并通過序列校驗和PDF校驗功能確保合規性。 加拿大NDA注冊申報相關技術支持。寧波中國eCTD服務放心可靠
技術壁壘與興市場挑戰 非洲和東南亞國家逐步采納eCTD,但其IT基礎設施薄弱導致實施進度滯后。歐盟通過“eCTD全球化倡議”提供技術援助,幫助興市場建立驗證體系和培訓中心。跨國藥企需針對不同區域定制遞交策略,例如在模塊1附加本地穩定性數據。 監管科學與創激勵 eCTD支持真實世界證據(RWE)和適應性臨床試驗設計的整合,加速創藥上市。EMA的PRIME計劃為突破性療法提供eCTD快速通道,允許分階段提交模塊數據。孤兒藥和兒科藥的eCTD序列可享受費用減免和優先審評。 供應鏈安全與審計追蹤 eCTD的XML主干文件記錄所有提交版本,支持供應鏈問題的追溯分析。原料藥CEP持有者需及時更變更信息,確保下游制劑廠商獲取數據。區塊鏈技術試點用于追蹤eCTD數據流,防止篡改和未授權訪問。 文化差異與實施障礙 部分南歐國家偏好傳統紙質流程,導致eCTD推廣阻力較大。EMA通過多語種培訓材料和區域協調員制度促進文化適應。行業需調整管理思維,將eCTD從“合規負擔”轉化為“競爭優勢”。蕪湖新藥eCTD報價加拿大eCTD注冊外包相關技術支持。
eCTD的法規框架與技術規范:歐盟eCTD的法規層級包括指南(Guidelines)、指令(Directive)和法規(Regulation)。其中,法規(如CTR)具有直接法律效力,而指南(如ICH eCTD規范)則為技術操作提供參考。eCTD的結構需符合歐盟模塊1規范(DTD 3.0+),包含行政文件(模塊1)、質量數據(模塊3)及臨床研究報告(模塊5)等內容,并通過XML文件實現數據互聯。例如,CEP(歐洲藥典適用性證書)的eCTD申報需單獨構建信封(Envelope)和模塊1,并指定標識符(UUID)以確保技術合規性。
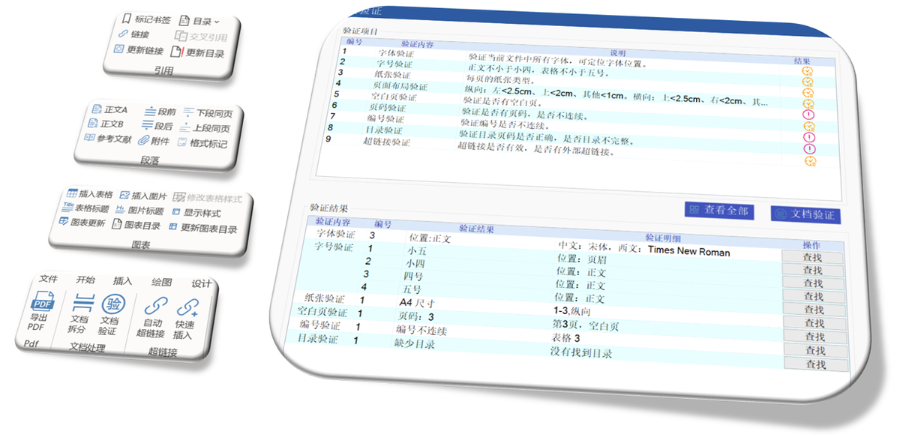
eCTD驗證標準的嚴格性與分類:歐盟對eCTD的驗證要求分為“錯誤”“警告”和“提示信息”三級,其中“錯誤”項直接導致申報被拒。驗證項目涵蓋六大類共149條,包括文件命名規范(如路徑長度限制)、PDF可讀性(禁止密碼保護)、XML骨架文件完整性等。例如,文件擴展名必須符合規范(如.xpt用于臨床數據集),而文件夾層級需避免空目錄或混合存放文件。相較于中國《電子申報驗證標準》的簡化版(54條),歐盟的驗證體系更為復雜,體現了其高標準的技術監管。瑞士eCTD注冊申報相關技術支持。
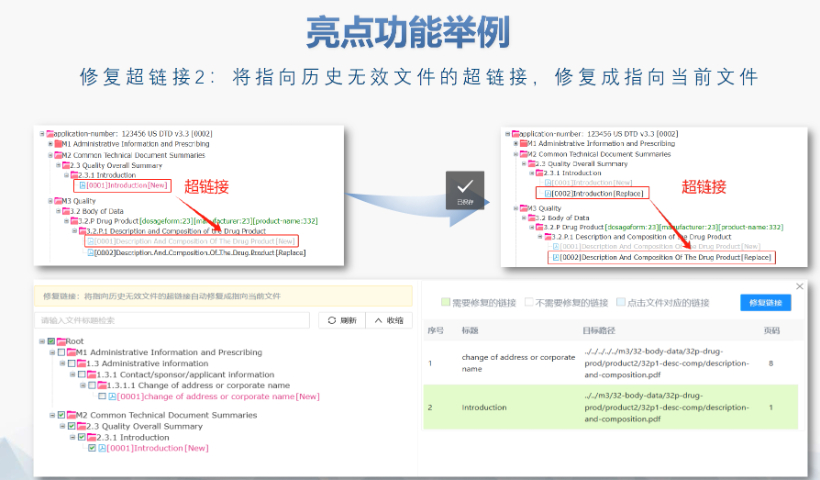
內容與格式檢查Word預處理:需檢查拼寫、縮略語、單位格式(如),設置多級列表自動編號(如),統一字體(宋體/TimesNewRoman)和段落格式。重復內容處理:相同劑型不同規格可共用模塊3,但需區分包裝系統(如、)。外文資料:中文在前、原文在后,參考文獻需中英文對照并建立跨網頁鏈接。使用符合ICH標準的eCTD編輯器自動生成XML骨架和MD5校驗值,拖拽PDF文件構建結構樹。序列管理:序列號從0000開始遞增,每次提交需更新序列,生命周期狀態(New/Replace/Delete)需在XML中明確標注。驗證與遞交:確保無驗證錯誤(如書簽缺失、超鏈接斷鏈),通過ESG等電子通道傳輸,光盤封面需包含申請號和序列號。全生命周期管理版本:通過軟件實現網頁簽入/簽出、審批流程,支持歷史版本追溯。變更管理:增補(Append)和替換(Replace)需關聯原始序列,刪除(Delete)需徹底移除無效文件。 美國eCTD注冊咨詢相關技術支持。安徽生物制品eCTD常用解決方案
eCTD注冊咨詢相關技術支持。寧波中國eCTD服務放心可靠
2015年發布《關于藥品醫療器械審評審批制度的意見》,提出藥監五大目標,將eCTD納入國家藥監數字化戰略。2017年,中國加入ICH(國際人用藥品注冊技術協調會),成為全球第八個監管機構成員,加速與國際標準接軌。2018年,國家藥監局(NMPA)完成eCTD文檔管理系統招標,由上海寶信與德國LORENZ合作搭建技術平臺,標志著技術基礎設施的落地。 ?規范制定與試點階段(2019-2023年)? 2019-2020年,CDE(藥品審評中心)發布《eCTD技術規范》《驗證標準》等征求意見稿,并組織兩輪企業測試。2021年,NMPA明確化學藥1類、5.1類及生物制品1類上市申請適用eCTD。2022年實施電子申報(非eCTD格式),2023年取消紙質資料提交,為eCTD鋪開奠定基礎。 ?實施與擴展階段(2024-2025年)? 2024年3月更電子申報技術要求,7月啟動網絡傳輸試點。2025年1月27日,NMPA將eCTD適用范圍擴大至化藥1-5類臨床試驗及上市申請、生物制品1-3類全流程,覆蓋藥、仿制藥及生物類似藥,實現與國際主流申報模式同步。寧波中國eCTD服務放心可靠
賦悅科技(杭州)有限責任公司在同行業領域中,一直處在一個不斷銳意進取,不斷制造創新的市場高度,多年以來致力于發展富有創新價值理念的產品標準,在浙江省等地區的數碼、電腦中始終保持良好的商業口碑,成績讓我們喜悅,但不會讓我們止步,殘酷的市場磨煉了我們堅強不屈的意志,和諧溫馨的工作環境,富有營養的公司土壤滋養著我們不斷開拓創新,勇于進取的無限潛力,賦悅科技供應攜手大家一起走向共同輝煌的未來,回首過去,我們不會因為取得了一點點成績而沾沾自喜,相反的是面對競爭越來越激烈的市場氛圍,我們更要明確自己的不足,做好迎接新挑戰的準備,要不畏困難,激流勇進,以一個更嶄新的精神面貌迎接大家,共同走向輝煌回來!
- 合肥eCTD哪家好 2025-04-13
- 安徽國際注冊eCTD銷售電話 2025-04-13
- 安徽中國eCTD服務放心可靠 2025-04-13
- 江蘇國內注冊eCTD服務商 2025-04-13
- 福建澳大利亞eCTD 2025-04-13
- 加拿大eCTD發布軟件 2025-04-13
- 楊浦區化學藥品eCTD使用 2025-04-13
- 北京加拿大eCTD 2025-04-13
- 浦東新區生物制品eCTD品牌 2025-04-12
- ANDAeCTD報價 2025-04-12
- 廣州外賣訂餐系統原理 2025-04-13
- 購買品牌策劃24小時服務 2025-04-13
- 濱湖區自制電子產品銷售價格多少 2025-04-13
- 浙江金融行業子母鐘售價 2025-04-13
- 工業園區正規智能手機售后保障 2025-04-13
- 潮州智能一體化檔案庫房價格 2025-04-13
- 昆山共享糖畫機怎么代理 2025-04-13
- 黑龍江國產品牌策劃結構設計 2025-04-13
- 江蘇電腦雙屏液晶升降一體機價格 2025-04-13
- 新藍機器人力控系統軟件 2025-04-13