寧波細胞培養試劑進出口政策
生物試劑出口前,產品認證是重要環節。對于出口到歐美等發達國家市場的生物試劑,通常需獲得當地認可的認證。如出口歐盟,多數生物試劑要依據歐盟相關指令與協調標準,完成 CE 認證,涵蓋產品安全性、健康影響、環保等多方面評估,通過認證機構檢測與審核后獲得認證證書。出口美國則需關注美國食品藥品監督管理局(FDA)要求,按照不同產品類別完成相應注冊、列名等程序,如醫療器械類生物試劑可能需進行 510 (k) 申請或上市前批準(PMA)等。通過這些認證流程,使出口生物試劑符合目標市場準入標準。出口生物試劑選擇物流時,要考量其與進口國當地配送的銜接。寧波細胞培養試劑進出口政策

無論是進口還是出口生物試劑,企業必須具備合法合規的經營資質。在進口方面,首要任務是完成對外貿易經營者備案登記,從而獲得合法的進出口經營權。倘若涉及藥品類生物試劑,企業必須持有藥品經營許可證,該證對企業的倉儲條件、人員資質等方面有著嚴格要求,以確保藥品類生物試劑在經營過程中的質量安全。對于醫療器械類生物試劑,企業需依據試劑的風險等級,準確取得醫療器械經營備案憑證或醫療器械經營許可證。出口企業同樣要完成對外貿易經營者備案,生產企業更是需要具備相應的藥品生產許可證或醫療器械生產許可證,以證明自身具備合規生產生物試劑的能力。此外,針對特定生物試劑,如高風險生物制品或涉及兩用物項的生物試劑,進出口均需獲得特別許可,像生物制品批簽發證明、兩用物項和技術進出口許可證等。企業務必提前按規定流程申請,任何疏忽導致的無證經營,都可能面臨罰款、貨物扣押等嚴重法律后果,甚至影響企業后續的業務開展與信譽。上海酶類試劑進出口貿易出口生物試劑要確保產品符合進口國的環保標準。
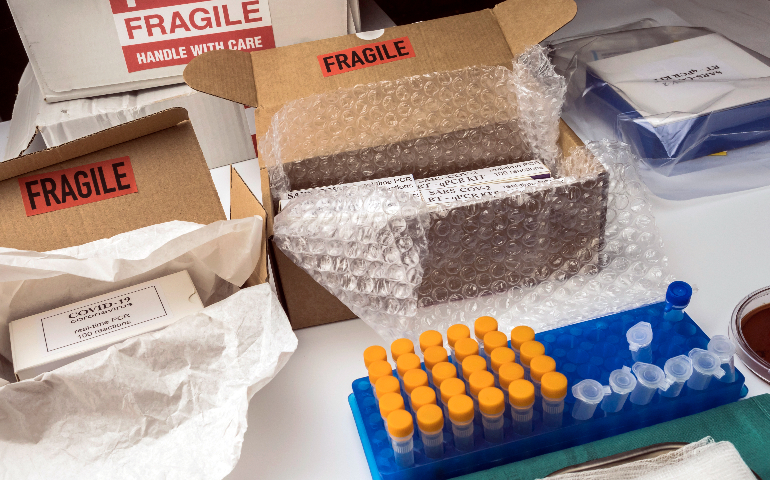
高效的供應鏈管理對生物試劑進出口至關重要。從采購環節開始,企業要與可靠的原材料供應商建立長期穩定合作關系,確保原材料質量穩定且供應及時。例如,生產抗體試劑所需的動物血清,需從符合質量標準的供應商處采購。倉儲管理方面,由于生物試劑特性各異,需分類存儲。對溫度敏感試劑要存放在專業冷鏈倉庫,嚴格控制溫度、濕度等環境參數。運輸過程中,構建多式聯運體系,結合公路、鐵路、航空運輸優勢,實現快速、安全運輸。同時,運用供應鏈管理系統,實時監控貨物運輸狀態、庫存水平等信息,以便及時調整生產、運輸和銷售計劃。通過優化供應鏈管理,降低成本,提高生物試劑進出口效率,保障產品質量與供應穩定性。
高風險生物試劑出口受到格外嚴格管控。像用于傳染病診斷、醫療的高敏生物試劑,以及可能涉及生物武器開發的特定生物試劑,出口前需通過多部門聯合審查。企業不要提供詳盡的產品研發、生產工藝、質量控制資料,還需證明產品用途的合法性與合理性。此類試劑出口必須獲得相關部門頒發的特別出口許可證,如依據《兩用物項和技術進出口許可證管理辦法》,對涉及兩用物項的生物試劑實施嚴格許可管理,防止敏感生物試劑流入非法渠道,維護全球生物安全與國際和平穩定。生物試劑進口要了解目的國對儲存條件的監管要求。

進出口生物試劑均需通過嚴格檢驗檢疫。出口時,企業要主動向海關與檢驗檢疫部門申報,提供詳細產品信息、生產批次、質量檢測報告等資料。檢驗檢疫部門會根據試劑特性與進口國要求,進行質量抽檢,檢測純度、活性、微生物限度等指標,對于一些傳染病診斷試劑,對其微生物限度和特異性要求極高。對可能攜帶病原體、有害生物因子的試劑進行生物安全檢測,防止有害生物跨境傳播。進口生物試劑時,同樣要接受我國檢驗檢疫部門查驗,企業需配合做好貨物查驗、抽樣檢測等工作,對于冷鏈生物試劑,還要滿足冷鏈貨物檢驗檢疫要求,如落實核酸檢測、消毒等防控措施,確保產品符合國內外檢驗檢疫標準,保障公共衛生安全與市場秩序,為國內科研、醫療等領域提供安全可靠的生物試劑。出口生物試劑要重視進口國對產品質量認證的要求。寧波細胞培養試劑進出口政策
生物試劑進口需提前與目的國的代理溝通清關事宜。寧波細胞培養試劑進出口政策
進境動植物源性生物試劑進口前,需向海關部門或出入境檢驗檢疫機構申請檢疫審批。企業需提交《進境動植物檢疫許可證》申請表,說明試劑中動植物源性成分的來源國家或地區、用途、生產加工工藝、儲存條件等信息。檢疫部門會評估試劑攜帶病蟲害、有害生物的風險,對于風險較高的試劑,可能要求企業提供額外的風險評估報告或采取特定檢疫措施。審批通過后,企業獲得《進境動植物檢疫許可證》,憑證辦理進口手續,防止外來有害生物通過生物試劑傳入國內,維護生態平衡與農業安全。寧波細胞培養試劑進出口政策
- 上海港出口監管倉庫在哪里 2025-04-28
- 茶葉國際快遞公司 2025-04-28
- 上海危險品監管倉儲 2025-04-28
- 寧波國際小件快遞推薦 2025-04-28
- 杭州國際商業快遞fedex折扣 2025-04-28
- 寧波修理物品進口報關資料 2025-04-28
- 上海化學試劑進口報關清關 2025-04-28
- 杭州酶類試劑進出口免費咨詢 2025-04-28
- 寧波海運進口報關服務 2025-04-28
- 南京易碎品國際快遞小件運輸 2025-04-28
- 重慶靠譜的美國專線物流 2025-04-28
- 廈門到美國清關代理服務價錢 2025-04-28
- 黑龍江激光切割機整車物流專線直達 2025-04-28
- 武漢本地搬運裝卸服務平臺 2025-04-28
- 江西工業風扇倉儲服務分揀打包代發貨 2025-04-28
- 四川藥品運輸費用 2025-04-28
- 梁溪區附近道路貨物運輸銷售價格 2025-04-28
- 保稅倉儲運輸服務收費標準 2025-04-28
- 廚具加拿大港口取柜哪家實惠 2025-04-28
- 貴州海運船期 2025-04-28